产品介绍
毒理信息通道查找PCR芯片(ToxPathFinder)是一种可用于毒理学作用机制研究的非常可靠而又操作简便的工具,在毒理学研究模型中,你只需通过检测主要毒理信息通道标志基因的表达情况,便可获知哪些信息通道参与了毒理应答反应,以及这些信息通道间的相互作用,找到了具体信息通道后,可对组成该通道更多基因进行表达分析,从而研究毒理学作用机制。ToxPathFinder采用SYBR实时荧光PCR方法,同时检测88个毒理信息通道标志基因的表达,包含的主要毒理信息通道有细胞凋亡通路, DNA损伤修复通路,免疫毒性通路,线粒体能量代谢通路,氧化应激通路,内质网应激通路。应用两块PCR芯片分别对实验样品和参照样品进行分析,您就能快速,方便,准确地获得88个毒理信息通道标志基因的相对表达含量。
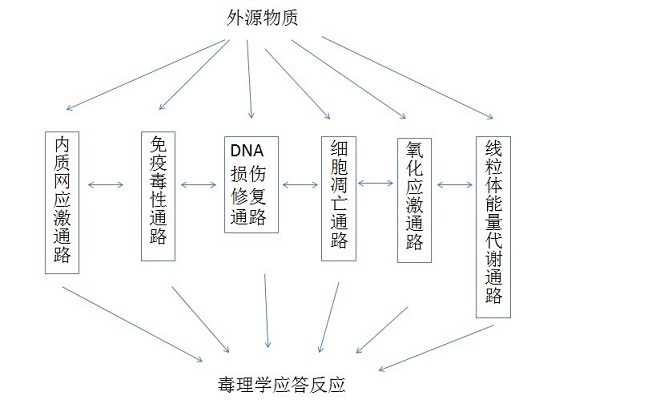
自由基主要产生于氧化反应,自由基浓度过高就会对细胞产生氧化损伤。当自由基浓度过高时,机体会产生防御反应来抵消活性氧(ROS)和氧化损伤,这些协调行为受转录因子E2相关因子2-抗氧化反应元件(NRF2/NFE2L2-ARE)信号通路的调控。在正常生理状态下,细胞核转录因子Nrf2位于细胞质中,处于无活性状态,通过N端的Neh2区域与分子伴侣Keap1结合形成二聚体,促进泛素蛋白酶体降解Nrf2,使Nrf2含量维持在一个较低的水平。以下两种情况下,Nrf2会与Keap1发生解离,一是外来物质的新陈代谢产生超氧化物和亲电物质或氧化刺激因子与Keap1反应引起Keap1构象发生变化,与Nrf2解离,Nrf2被激活;二是蛋白激酶C(PKC)、丝裂原活化蛋白激酶(MAPKs)或磷脂酰肌醇激酶(PI3K)作用于Nrf2导致其磷酸化,从而与Keap1解离,Nrf2被激活。激活后的Nrf2转移入细胞核中,与ARE结合共同调控抗氧化基因的转录和表达,这些因子包括下游Ⅱ相解毒酶(如CAT、SOD、GST、GSH、UGT)、第3阶段解毒酶和1组26S蛋白酶体亚基及其他一些抗氧化防御因子和炎症因子,除此之外,还包括编码第1阶段的各个药物代谢酶,如色素2A4,2A12,4A10,2C39等同工酶类,醛-酮还原酶类,羰基还原酶1、羰基还原酶3,第2阶段的药物代谢酶,如耐药性相关蛋白排出泵,该通路活化过程如图所示。该信号通路参与抗肿瘤、调节肌肉生长、抗凋亡、抗炎症、抗动脉粥样硬化、神经保护等细胞保护功能。该通路的PCR芯片可以帮助研究针对上述疾病的药物对氧化应激通路激活或抑制作用,从而对药物药理毒理作用做出评价。
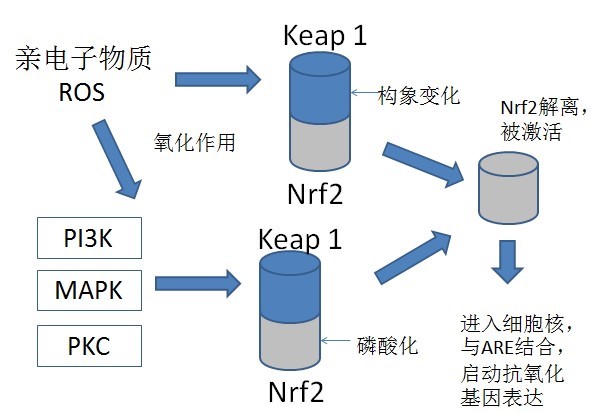
核因子κB(nuclear factor – kappa B,NF-κB)是普遍存在于细胞浆中以p50/p65异二聚体为形式的一种快反应转录因子,与NF-κB的抑制性蛋白(inhibitor kappa B, IκB)结合而呈非活性状态。当细胞受到病原微生物、应激、细胞因子、癌蛋白和紫外线刺激时,上游激酶使IκB磷酸化,从而引起IκB降解,游离的NF-κB在其核转位信号NTS介导下,移位到细胞核,结合靶基因启动子区域的κB位点,调节靶基因的表达,启动靶基因表达后,NF-κB与新合成和积聚的IκB重新结合,IκB上的核转出信号NES被核蛋白CRM1特异识别,经核孔移出核进入胞浆失活。该通路参与众多基因的调控,包括病毒瘤基因、免疫调节因子、白细胞粘附分子、急性期反应蛋白、细胞因子、生长因子、转录和生长调控因子等,这些基因其启动子上都有κB位点。目前发现,NF-κB信号通路的过度活化与如下人类疾病的发生密切相关: 哮喘、类风湿性关节炎、炎症性肠病、肾小球肾炎、幽门螺旋杆菌相关性胃炎、全身性炎症反应综合症、慢性炎症性脱髓鞘多发性神经根炎、感染性休克、中毒性休克、动脉粥样硬化、多发性硬化症、肺纤维化、糖尿病、甲状腺功能异常综合征、银屑病、 肿瘤 (乳腺癌、非小细胞肺癌、甲状腺癌、结肠癌、卵巢癌、前列腺癌、某些病毒诱导的肿瘤、T或B淋巴细胞性白血病和淋巴瘤)、Alzheimer病等。该通路PCR芯片可帮助研究药物或环境有毒物质对该通路的激活或抑制作用,评价药物活环境有毒物质对机体的免疫毒性或免疫抑制作用。
机体代谢过程产生的物质或外来药物,尤其是一些抗癌药物易引发DNA损伤,DNA损伤能够引发多种细胞反应,包括激活DNA修复系统、激活DNA损伤关卡,使细胞周期阻滞,以便细胞有充分时间进行修复、使一些损伤严重细胞发生凋亡等。首先要由DNA损伤感应因子识别DNA损伤,这些感应因子主要有ATM和ATR两个蛋白,DNA损伤被识别后,由Chk1和Chk2进行传导,再由一些效应因子如Cdc25A等引发一系列细胞效应。利用PCR芯片对DNA损伤通路分子表达进行研究,有助于探索药物或遗传毒物对DNA损伤分子作用机制,从分子水平反映药物或遗传毒物对生物体的危害。
细胞凋亡过程大致可分为几个阶段:接受凋亡信号,凋亡调控分子间的相互作用,蛋白水解酶的活化(Caspase),进入连续反应过程。通过Fas介导的膜受体通路或线粒体释放的细胞色素C激活蛋白水解酶,蛋白水解酶不可逆的水解底物,造成调节蛋白丧失功能,激活核酸酶,或破坏细胞结构等,完成细胞凋亡过程。一些关键性的凋亡抑制分子参与细胞凋亡的调控,如p53,以竞争性结合方式与靶分子形成稳定的具空间位阻效应的复合体抑制Caspases活性;Bcl-2家族等。细胞凋亡PCR芯片可用于在毒理学研究模型中细胞死亡机制的研究等。
氧化呼吸链和三羧酸循环是线粒体进行能量代谢的主要途径,NADH链及FADH2呼吸链是线粒体内膜参与电子传递产能的主要组成部分,这两种过程产生的能量在ATP合成酶复合体作用下驱动氧化磷酸化和ATP合成。这些过程调节异常是造成癌变的一个重要病理途径,研究发现许多肿瘤伴随有线粒体呼吸链组成成分表达量的降低,同时,线粒体代谢异常还与肥胖及各种代谢综合征相关,线粒体能量代谢PCR芯片可检测该通路中参与各个途径酶的基因表达情况,找寻线粒体中异常代谢途径,研究疾病发生机制或有毒物质对线粒体能量代谢的影响。
当细胞受到外界刺激时会诱发内质网应激效应(ERS),内质网内未折叠蛋白增多,蛋白激酶R样内质网调节激酶(PERK)和肌醇需酶1(IRE1)以及活化转录因子6(ATF6)的伴侣分子葡萄糖调节蛋白78(GRP78)开始释放,结合未折叠蛋白质,促进蛋白质的正确折叠。PERK和IRE1蛋白与GPR78解离后,发生低聚反应及自身磷酸化而被激活,而游离的ATF6则转入高尔基体内被蛋白质水解酶水解成转录因子,这些活性成分诱导ERS下游信息传递及其基因表达,启动未折叠蛋白反应(UPR),UPR主要通过增加内质网伴侣分子的表达和抑制蛋白质翻译以及加速蛋白质从内质网反向转运至细胞质内,进而被蛋白质水解酶水解来降低未折叠蛋白。如果UPR的适应性反应不能控制内质网应激,细胞就会进入到凋亡途径。由于多种诱导因素会导致内质网应激,比如缺氧,缺血,高脂,高糖,缺血再灌注等,因此涉及到内质网应激的疾病如心功能不全、冠状动脉粥样硬化,脑出血,白内障,糖尿病等。内质网应激通路PCR芯片对进一步了解相关疾病发病机制,寻找新的治疗方法提供帮助,还可用于研究药物如一些蛋白质合成抑制剂对内质网应激通路的影响。
使用Toxicity Pathway Finder PCR芯片研究实例
目前已有很多成功利用PCR芯片进行分子毒理学研究的例子,Singh等人[1]利用毒理学相关通路PCR芯片寻找氯氰菊酯对小鼠中枢神经系统产生毒性作用的机理,该PCR芯片包括的通路有DNA损伤信号通路,氧化应激/抗氧化信号通路等相关基因,利用此PCR芯片检测暴露于氯氰菊酯的小鼠脑内毒理学途径相关基因表达情况,结果显示小鼠脑内GSH含量明显减少,脂质过氧化反应明显增强,说明氯氰菊酯在小鼠脑内明显激活氧化应激信号通路,并且氧化应激反应最终导致DNA损伤。Helmig等人[2]同样利用PCR芯片研究纤维状及颗粒状尘埃对人体造成的危害,该PCR芯片包含应激反应的毒理学信号通路相关基因,对暴露于上述尘埃的支气管上皮细胞的基因表达情况进行研究,结果表明尘埃可通过激活氧化应激通路,炎性反应等分子信号通路对人体产生直接危害,这项研究也说明PCR芯片是一种可作为评价新型材料或环境毒物的危害性的非常有用的工具。Oleaga等人[3]利用PCR芯片研究可可粉的多酚提取液对乳腺癌细胞系MCF-7和SKBR3的作用,该PCR芯片包含应激反应的毒理学信号通路相关基因,筛选出在两种细胞系中均有异常表达的代表性基因CYP1A1作进一步的研究,结果表明多酚提取液联合三苯氧胺可对乳腺癌细胞产生细胞毒性,引起细胞凋亡,对临床联合用药起指导作用。
参考文献:
[1] Singh P, Lata P, Patel S, Pandey AK, Jain SK, Shanker R, Dhawan A.
Expression profiling of toxicity pathway genes by real-time PCR array in cypermethrin-exposed
mouse brain
[J]. Toxicol Mech Methods,2011 ,21(3):193-199.
[2] Helmig S, Dopp E, Wenzel S, Walter D, Schneider J.
Induction of altered mRNA expression profiles caused by fibrous and granular dust
[J]. Mol Med Rep,2013.
[3] Oleaga C, García M, Solé A, Ciudad CJ, Izquierdo-Pulido M, Noé V.
CYP1A1 is overexpressed upon incubation of breast cancer cells with a polyphenolic cocoa extract
[J]. Eur J Nutr,2012,51(4):465-476.